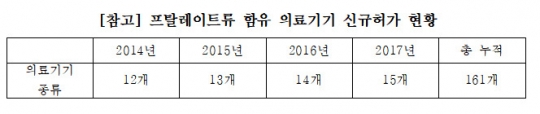
프랄레이트 함유 의료기기 신규허가 현황. /김명연 의원실
생식기능 저하, 호르몬분비 불균형 등을 유발하는 발암물질인 프랄레이트 성분이 함유된 의료기기가 국내 유통되는 것으로 나타났다. 국내 의료기기 내 프랄레이트 함유량은 유럽 지역의 최대 400배에 달했다.
17일 국회 보건복지위원회 소속 김명연 의원(자유한국당)이 식품의약품안전처로부터 제출받은 '발암물질로 분류된 프탈레이트류 함유 의료기기 허가 상황'에 따르면 현재까지 허가된 발암물질 의료기기는 수혈세트, 수혈용채혈 세트 등 총 161개다.
프탈레이트는 세계보건기구(WHO) 지정 2B 발암물질이다. 이 성분은 생식 기능을 낮추고 호르몬 분비 불균형을 유발한다. 유럽에서는 프탈레이트 성분 의료기기의 사용을 제한한다. 2017년 제정된 유럽연합(EU) 의료기기 지침에 따르면 인체에 삽입되거나 접촉 또는 주입 등을 위한 의료기기는 프탈레이트 함유량을 의료기기 총 중량의 0.1% 미만으로 하라고 지정했다.
하지만 국내에서 유통되는 인공신장기용 혈액회로는 프탈레이트 함유량이 전체 중량의 20~40%, 수혈용 채혈세트는 10~40%에 이른다. EU 기준인 0.1%와 비교하면 최대 400배에 달하는 프탈레이트 성분이 함유된 셈이다.
식약처는 2015년 프탈레이트류 성분이 함유된 수액백, 튜브 등 수액세트 유통을 전면 금지했다. 하지만 후속 대책을 내놓지 못하고 그동안 신규 허가를 늘려왔다. 이에 김 의원은 식약처가 규제에 소극적이었다고 지적했다.
실제 김 의원이 식약처로부터 받은 '프탈레이트류 함유 의료기기 신규 허가현황'에 따르면 2015년 13개를 신규 허가했다. 지난해 14개, 올해 15개 등으로 신규 허가가 늘고 있다.
김 의원은 "안전하다고 여겨왔던 의료기기에 발암물질이 뒤범벅되어 있다는 것에 많은 국민이 충격을 받았다"며 "국민 건강을 위해 식약처는 EU의 기준처럼 사용 제한을 추진해야 한다"고 강조했다.
이에 대해 식약처 관계자는 "프탈레이트류 성분이 함유된 수액세트 생산·수입을 금지한 것은 우리나라가 최초"라며 "올해 EU의 의료기기 지침 제정 전까지는 우리나라가 규제에 가장 앞섰다. 향후 논의를 통해 규제방안을 마련해 나가겠다"고 밝혔다.





 Copyright ⓒ 메트로신문 & metroseoul.co.kr
Copyright ⓒ 메트로신문 & metroseoul.co.kr